
Princípios para a Obtenção do Certificado de Boas Práticas de Fabricação de Produtos Para a Saúde– CBPF (RDC16:2013)– ANVISA
Categoria: Artigo, Blog, qualificação, validação
Atualmente estamos vivendo um grande marco regulatório, que nada mais é do que um conjunto de normas, leis e diretrizes que vem regulamentando o funcionamento das empresas dos ramos industriais, principalmente de medicamentos e produtos para a saúde. Todos os movimentos que estão acontecendo, vêm exercendo um impacto direto no cumprimento das Boas Práticas de Fabricação – BPF, que é um sistema de qualidade padronizado e contínuo que tem o objetivo de selecionar, avaliar, instalar, produzir, testar, qualificar, validar e manter os processos e produtos com alto nível de qualidade e segurança.
Portanto, para se obter um documento comprobatório de Boas Práticas de Fabricação com foco em indústrias de Produtos para a Saúde, é essencial estar atento há algumas premissas que norteiam a aprovação dos cumprimentos de todas as exigências dos órgãos reguladores. Para isso é importante entender a RDC 16, de 28 de março de 2013 – Aprova o Regulamento Técnico de Boas Práticas de Fabricação de Produtos Médico e Produtos para Diagnóstico de Uso In Vitro, e que diretamente ligada a ela, existe a Lei nº 6.360, de 23 de setembro de 1976 – Dispõe sobre a vigilância sanitária a responsabilidade de fiscalizar e orientar os estabelecimentos de produtos para a saúde e outros, cujo principal foco é fiscalizar e auditar se os estabelecimentos têm condições sanitárias para desempenhar todas as atividades propostas.
Visando o atendimento das normativas acima, as indústrias que produzem Produtos para a Saúde/Médicos (Correlatos), precisam se enquadrar nos requisitos da RDC39, 14 de agosto de 2013, que Dispõe sobre os procedimentos administrativos para concessão da Certificação de Boas Práticas de Fabricação (CBPF) e da Certificação de Boas Práticas de Distribuição e/ou Armazenagem (CBPDA). Esses documentos são emitidos pela Agência Nacional de Vigilância Sanitária (ANVISA), atestando que determinado estabelecimento cumpre com as Boas Práticas de Fabricação, Distribuição e Armazenamento, dispostas na legislação em vigor em relação a produção de produtos.
O Certificado de BPF descreverá para cada linha de produção as respectivas classes de risco de produtos para as quais o estabelecimento encontra-se em conformidade com os requisitos preconizados pelas normas vigentes de Boas Práticas. Esta classificação está descrita na RDC 185, de 22 de outubro de 2001, e os produtos enquadrados segundo o risco intensivo que representam à saúde do consumidor, paciente, operador ou terceiros envolvidos, que podem ser:
- Não Invasivo: pele intacta ou lesões
- Invasivo: orifício natural ou cirurgia
- Transitório: até 60 minutos de uso contínuo
- Curto Prazo: até 30 dias de uso contínuo
Baseando-se nos riscos, temos as classificações descriminadas como Classes I, II, III ou IV, para o enquadramento do produto médico em uma destas classes, devem ser aplicadas as regras (1 até 18) descritas no Anexo II da RDC 185:2001. A certificação que é emitida para as atividades de produtos das classes III e IV, tem validade de dois anos, contados a partir da data de sua publicação no Diário Oficial da União (DOU). O modelo do certificado emitido está apresentado na imagem 01 abaixo.

Imagem 01 – Modelo do Certificado de Boas Práticas de Fabricação
A estruturação a ser seguida para a obtenção do certificado segue conforme os princípios determinados nas normativas regidas pela ANVISA, já mencionadas anteriormente e também as definidas no Decreto 8.077, de 14 de agosto de 2013 – Regulamenta as condições para o funcionamento de empresas sujeitas ao licenciamento sanitário, e o registro, controle e monitoramento, no âmbito da vigilância sanitária, dos produtos de que trata a Lei 6.360:1976. As orientações em relação às condições para uma empresa funcionar deverá seguir conforme descritas no diagrama abaixo (imagem 02).
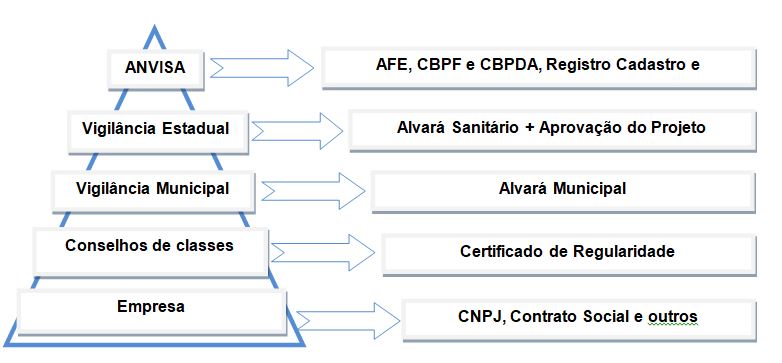
Imagem 02 – Diagrama de Regularização junto aos Órgãos Fiscalizadores
Além da documentação descrita no diagrama acima, também são necessários outros documentos legais e providências necessárias para a empresa funcionar de forma integra e padronizada, como, por exemplo:
- Alvará de bombeiros;
- Licença ambiental;
- Comprovar disponibilidade de instalações, equipamentos e aparelhagem em condições adequadas;
- Dispor de meios para a garantia da qualidade dos produtos e das atividades exercidas pelo estabelecimento;
- Dispor de recursos humanos capacitados ao exercício das atividades;
- Dispor de meios capazes de prevenir, eliminar ou reduzir riscos ambientais decorrentes das atividades exercidas pelo estabelecimento que tenham efeitos nocivos à saúde.
Todos os conjuntos de exigências e inovações tecnológicas proporcionam um diferencial em relação à produção, gerando mais produtividade e segurança das etapas produtivas.
Conclui-se que, se as indústrias, seguirem cada uma as suas responsabilidades especificas, visando sempre à melhoria continuada, analisando riscos, tendências e o monitoramento contínuo dos seus processos em prol do principal foco que é garantir a qualidade, segurança e eficácia dos produtos, tudo ficará mais produtivo, tranquilo e transformador em manter as regras de Boas Práticas de Fabricação de Produtos para a Saúde. Entende-se que os desafios serão cada vez maiores e que para todos os atendimentos das exigências se faz necessário seguir uma estratégia de engajamento, treinamentos, conhecimentos amplos e conscientização das equipes multidisciplinares dentro das instituições. Dúvidas e incertezas não podem mais fazer parte das cadeias produtivas e dos sistemas de gestão da qualidade, que tem uma missão possível para desenvolver com os profissionais do futuro.
Como diz a mentora Daniela Silva. Águias voam com águias e bora qualificar e validar para garantir a qualidade “sempre“…
Referências Bibliográficas:
– RDC N°16, DE 28 DE MARÇO DE 2013 – Aprova o Regulamento Técnico de Boas Práticas de Fabricação de Produtos Médicos e Produtos para Diagnóstico de Uso In Vitro e dá outras providências.
– RDC Nº 39, DE 14 DE AGOSTO DE 2013 – Dispõe sobre os procedimentos administrativos para concessão da Certificação de Boas Práticas de Fabricação e da Certificação de Boas Práticas de Distribuição e/ou Armazenagem.
– RDC Nº 185, DE 22 DE OUTUBRO DE 2001 – Aprova o Regulamento Técnico que consta no anexo desta Resolução, que trata do registro, alteração, revalidação e cancelamento do registro de produtos médicos na Agência Nacional de Vigilância Sanitária – ANVISA.
– LEI Nº 6.360, DE 23 DE SETEMBRO DE 1976 – Dispõe sobre a vigilância sanitária a que ficam sujeitos os medicamentos, as drogas, os insumos farmacêuticos e correlatos, cosméticos, saneantes e outros produtos, e dá outras providências.
– DECRETO Nº 8.077, DE 14 DE AGOSTO DE 2013 Regulamenta as condições para o funcionamento de empresas sujeitas ao licenciamento sanitário, e o registro, controle e monitoramento, no âmbito da vigilância sanitária, dos produtos de que trata a Lei no 6.360, de 23 de setembro de 1976, e dá outras providências.
Escrito por:
Fernanda Santos dos Santos: Química Industrial formada pela PUCRS, Campus de Porto Alegre – RS. Atua na área industrial de produtos para saúde desde 2011, com experiência em gestão de produção, controle de qualidade, gestão da qualidade e os processos de Qualificações e Validações.
Participação dos grupos de Mentoria Platinum de Daniela Silva, desde junho de 2020.
