
A Nova revisão do POP-O-SNVS-014
Categoria: Artigo, Blog, qualificação, validação
O ano de 2024 começou com o anúncio de revisão de um dos procedimentos do sistema nacional de vigilância sanitária mais conhecidos do setor regulado, o famoso POP-O-SNVS-014 que trata da categorização de não conformidades e classificação de estabelecimentos quanto ao cumprimento das boas práticas e possui aplicação em especial nas inspeções de Boas Práticas de Fabricação de Medicamentos e Insumos Farmacêuticos.
A revisão 04 do procedimento entrará em vigência em 04/03/2024 e a sua revisão ocorreu para a adequação do procedimento com o guia PIC/S PI 040-1, Guidance on Classification of GMP Deficiencies, January 2019; sendo essa uma forma de padronizar a forma de categorização das não conformidades identificadas nas inspeções e da classificação dos estabelecimentos.
Essa alteração de procedimento é essencial e natural uma vez que a ANVISA é o 54º membro do Esquema de Cooperação em Inspeção Farmacêutica (PIC/s), e é necessário que a forma de atuação esteja alinhada com as práticas da organização internacional que reúne autoridades reguladoras farmacêuticas para promover a harmonização de padrões de inspeção e regulamentações na indústria farmacêutica.
Sabemos que o ano de 2019 foi decisivo para impulsionar o processo de adesão ao PIC/S e ficou marcado por alterações importantes como a alteração do marco regulatório para as boas práticas de fabricação de medicamentos no Brasil.
O objetivo do PIC/S PI 040-1 é fornecer orientação sobre a classificação de deficiências encontradas durante inspeções de Boas Práticas de Fabricação em instalações farmacêuticas. Ele fornece uma estrutura para avaliar e classificar a gravidade das deficiências encontradas, com base em critérios como impacto na qualidade e segurança do produto, conformidade regulatória e riscos para os pacientes.
Essa classificação de deficiências é crucial para as autoridades reguladoras na determinação das ações corretivas necessárias e na avaliação do risco associado a produtos farmacêuticos fabricados em instalações com deficiências. Isso ajuda a garantir que os produtos farmacêuticos atendam aos padrões de qualidade e segurança exigidos pelas regulamentações sanitárias.
Um aspecto importante no procedimento é a forma de relatar uma não conformidade, sendo esse um dos aspectos que reforçamos em nossos treinamentos sobre formação de auditores. Ao descrever a não conformidade é importante relatar o que não está conforme com base em uma evidência objetiva rastreável para a empresa auditada e que essa recaia sobre um descumprimento ou implementação parcial de algum requisito normativo. Ao verificarmos o quadro de relato de uma NC vemos esses conceitos e entendimento presentes.
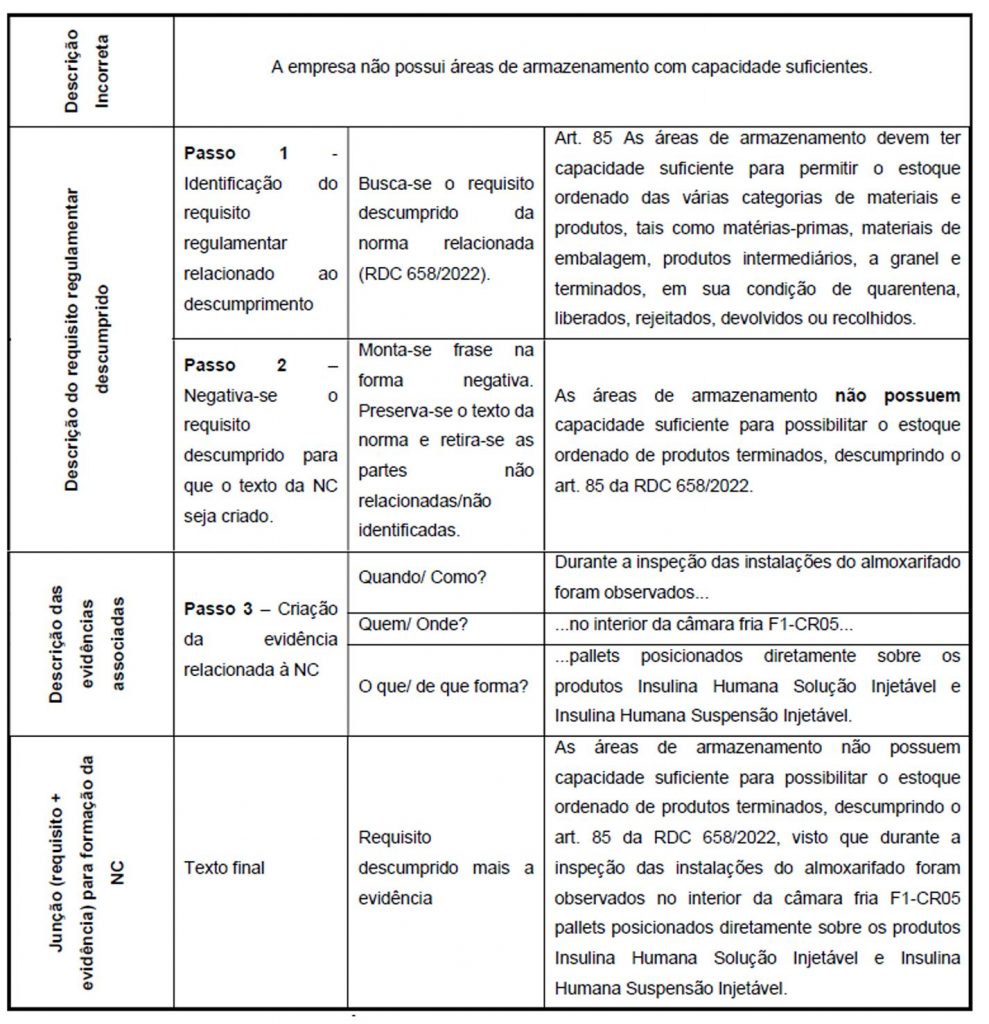
Fonte: POP-O-SNVS-014, disponível em https://www.gov.br/anvisa/pt-br/centraisdeconteudo/publicacoes/certificacao-e-fiscalizacao/compilado-procedimentos-SNVS/0014-pop-o-snvs-014
De acordo com a revisão 04 do procedimento, as não conformidades (NC) podem ser:
Críticas: “Uma NC é considerada “Crítica” quando resulta ou apresenta um risco significativo de resultar em um produto prejudicial ao paciente. Uma NC Crítica também ocorre quando o fabricante se envolve em fraude, má representação ou falsificação de produtos. Além disso, uma NC Crítica pode ser composta por várias NC inter-relacionadas, que individualmente não seriam consideradas críticas, mas juntas representam uma NC Crítica. Geralmente, uma NC Crítica está associada a uma medida preventiva.”
Maiores: “Trata-se de uma NC que não fora classificada como crítica, mas resultou, ou pode resultar, em um produto não conforme com seu registro sanitário, autorização de ensaio clínico, especificações do produto, requisitos farmacopeicos. Também se aplica quando não garante a implementação efetiva das medidas de controle de BPF exigidas, indica um desvio significativo dos termos do registro sanitário ou aponta uma falha na realização de procedimentos adequados para a liberação de lotes. Além disso, pode consistir em várias NC “Outras” inter-relacionadas, que juntas podem representar uma NC Maior, devendo ser explicadas e relatadas dessa forma.”
Outra: “Trata-se de uma NC que não se enquadra nas categorias Crítica ou Maior, mas aponta uma inconsistência em relação às Boas Práticas de Fabricação. Uma NC pode ser classificada como Outra quando não há informações suficientes para categorizá-la como Crítica ou Maior”.
A forma de categorizar as não conformidades inclui princípios de gestão de riscos e está relacionada a utilização de ferramenta de categorização de não conformidades presente no procedimento e que leva em consideração atenuantes (que podem reduzir o nível de criticidade de uma não conformidade) e agravantes (que aumentam o nível de criticidade). Há ainda alguns exemplos (não extensivo) de não conformidades críticas e maiores sem agravantes ou atenuantes.
Um dos exemplos que temos de não conformidade crítica é “Ausência, falsificação ou representação equivocada (intencional) de resultados analíticos ou registros de fabricação e embalagem”. Além disso, Fraude, representação intencionalmente incorreta ou falsificação intencional dos produtos ou dados (informações e documentos) ensejam na classificação “Não Cumpre BPF” com a aplicação de medidas preventivas/cautelares.
A depender das não conformidades e dos seus alcances, pode ser necessário o estabelecimento de medidas cautelares, conforme prevê o quadro a seguir:
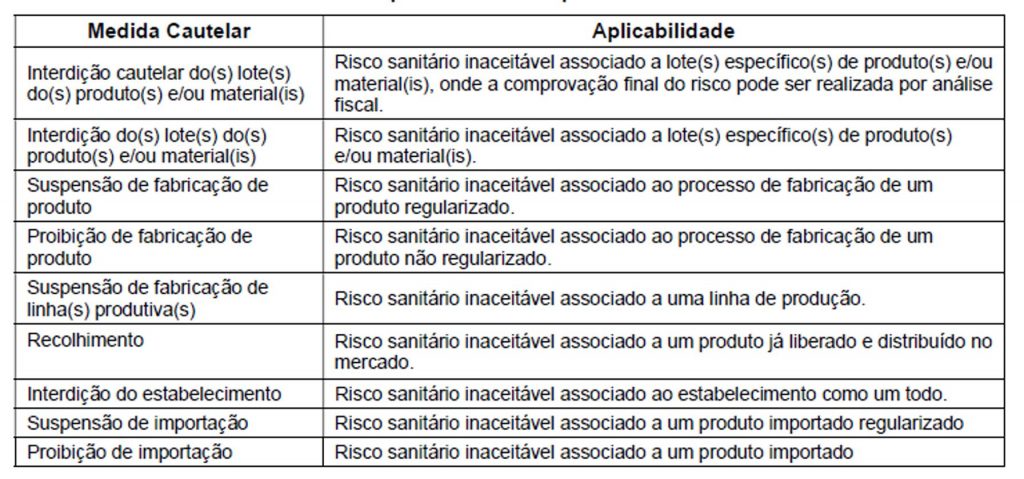
Fonte: POP-O-SNVS-014, disponível em https://www.gov.br/anvisa/pt-br/centraisdeconteudo/publicacoes/certificacao-e-fiscalizacao/compilado-procedimentos-SNVS/0014-pop-o-snvs-014
A inspeção pode resultar em Cumpre BPF e Cumpre BPF com Ações Corretivas e podem resultar na certificação de BPF e licenciamento do estabelecimento ou linha de produção ou forma farmacêutica. Para o CBPF, é imprescindível que o plano de ações propostas e adotadas pela empresa inspecionada seja considerado satisfatório pela autoridade regulatória para mitigação dos riscos atrelados às NC identificadas.
Já a classificação “Não cumpre BPF” leva ao indeferimento do CBPF e deve indicar não certificação exclusivamente das linhas, formas farmacêuticas, ou estabelecimento que não cumprem as BPF.
Os estabelecimentos podem ser classificados, de acordo com o risco, em:
- Grupo I – risco baixo: Estabelecimentos que não tiveram qualquer NC maior ou crítica.
- Grupo II – risco médio: Estabelecimentos que tiveram até 5 NC maiores.
- Grupo III – risco alto: Estabelecimentos que apresentaram mais de 5 NC maiores, ou NC crítica.
Escrito por:
Rodolfo Andrade Rodrigues, Bacharel em Química com Atribuições Tecnológicas e Bacharelando em Estatística, Especialista em Estatística Aplicada, MBA Desenvolvimento de Pessoas. Atua há mais de 15 anos na Indústria Farmacêutica, tendo realizado mais de 300 auditorias de qualificação de fornecedores, participações nacionais e internacionais em certificação de BPF da ANVISA. É responsável por gerenciamento de riscos, qualificação de fornecedores, auditorias internas e por validação de sistemas computadorizados na Indústria farmacêutica.
