
Validação de planilhas eletrônicas conforme o Guia 33/2020
Categoria: Artigo, Blog, Consultoria, qualificação, validação
Vivemos hoje no Brasil um momento único de renovação e introdução de novos conceitos regulatórios, onde muitos desses conceitos já são internacionalmente implementados e exigidos, mas que após o Marco Regulatório promovido pela Agência Nacional de Vigilância Sanitária – ANVISA passaram a ser contemplados dentro das novas resoluções e diretrizes regulatórias através da introdução da RDC 301/2019 e das suas Instruções Normativas, que visam principalmente promover uma harmonização com o Co-operation Scheme (PIC/s), bem como as diretrizes relacionadas ao International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) e outras normas internacionais, como o GAMP 5 publicado pelo International Society for Pharmaceutical Engineering (ISPE).
E é dentro desse novo universo regulatório brasileiro que nos deparamos com um grande impasse que vem nos acompanhando desde a publicação pela ANVISA do primeiro Guia de Validação de Sistemas Computadorizados em abril de 2010 e que após 10 Anos retorna junto à publicação em Abril/2020 pela ANVISA do novo Guia de Validação de Sistemas Computadorizados – Guia 33/2020:

No artigo anterior, Validação de Planilhas Eletrônicas: Uma estratégia para a implementação, escrito em 2018 e publicado aqui no site da MD Consultoria, foi apresentado a vocês uma estratégia focada e voltada para o desenvolvimento de uma planilha eletrônica que atendesse tanto os requisitos previstos na legislação de boas práticas de fabricação de medicamentos vigente na época (RDC 17/2010), como também baseado na estratégia apresentada pelo GAMP5, permitindo que a estratégia discutida se mantenha aplicável e possa ainda ser utilizada dentro das nossas rotinas, mesmo com a vigência da nova legislação de boas práticas de fabricação (RDC 301/2019).
Entretanto, vale ressaltar que a RDC 301/2019 busca promover uma evolução dos conceitos de boas práticas, bem como uma maior aplicação e implementação das rotinas que visam principalmente a melhoria contínua e a obtenção de uma maior qualidade, segurança, integridade e rastreabilidade de tudo que envolva as boas práticas.
Sendo assim, para atendimento dos novos conceitos regulatórios previstos na RDC 301/2019 faz-se necessário também a evolução e aprofundamento desses conceitos, bem como dos ciclos de vida desenvolvidos e aplicados a atividade de validação de planilhas eletrônicas, uma vez que passamos a ter uma maior atribuição e cobranças voltadas a garantir a integridade e segurança de dados.
Outro ponto que vem sendo bastante discutido e abordado dentro da RDC 301/2019 e suas Instruções Normativas está relacionado ao processo e a aplicação do Gerenciamento de Riscos, o qual aconselhamos seguir as diretrizes apresentadas no ICH-Q9, devendo este ser abordado de forma mais abrangente permitindo que seja apresentado de forma clara, todos os recursos e itens relacionados às rotinas industriais farmacêuticas e ser mantido atualizado e condizente com todas as recomendações e atualizações regulatórias que, para nossa sorte, estão em constante evolução e desenvolvimento.
Olhando de forma mais crítica para as nossas rotinas diárias, temos uma ampla utilização de planilhas eletrônicas nos processos devido à grande acessibilidade e flexibilidade dessa ferramenta. Elas são utilizadas para controles mais administrativos, como no controle e gerenciamento de atividades diárias, assim como em processos considerados mais complexos e críticos, por exemplo, as planilhas utilizadas para gestão dos pontos de controle, geração de informações para tomadas de decisões de negócio ou regulatórias e na realização de cálculos (dos mais simples aos altamente complexos) que geram resultados analíticos e consequentemente decisórios.
E são nesses momentos que começam a gerar outras dúvidas dentro das nossas rotinas e atuações…

E a resposta é a mesma que sempre comentamos nas nossas discussões, onde para alguns a resposta pode ser um “clichê” ou “padrão” e para outros é interpretada como sendo uma “falta de suporte e auxílio”, mas infelizmente (ou felizmente), essa resposta está INTEIRAMENTE envolvida com a nossa realidade atual frente o marco regulatório:
Vai depender do Risco identificado na sua Análise de Risco e relacionado a realidade da sua empresa.

E a resposta é sempre a mesma: Claro!
Não só uma Análise de Risco, mas você precisa ter definido e implementado dentro da sua empresa um sistema de qualidade capaz de identificar, orientar e desenvolver estratégias que estejam devidamente alinhadas aos requerimentos regulatórios existentes e que possibilitem um processo de inclusão, gerenciamento, controle e manutenção dessas ferramentas tão flexíveis e de uso tão abrangente, possibilitando que você sempre busque despender energia e tempo para os processos críticos e de impacto significativo dentro das rotinas BPx, assim como desenvolver estratégias seguras e precisas para que as planilhas eletrônicas que você possui em uso dentro da sua rotina sejam devidamente documentadas e regulamentadas dentro do seu sistema de qualidade.

Em primeiro lugar é necessário a correta identificação da funcionalidade e necessidade da planilha eletrônica, e para isso é preciso inicialmente ter o conhecimento profundo do processo, obtido geralmente através de um Mapeamento do Processo e/ou Rotina, de forma a possibilitar a identificação e a avaliação de todas as entradas e saídas, fluxo e interfaces relacionadas a planilha eletrônica.
Para isso, tenhamos em mente algumas perguntas simples e que são chaves para entender o uso da sua ferramenta.

Se você respondeu SIM para alguma dessas perguntas você possui uma planilha com potencial risco para as rotinas e atividades das Boas Práticas.
E é nesse contexto que retornamos a pergunta anterior cuja resposta também é simples!
A estratégia definida deve garantir um processo robusto e reguladoramente seguro para o uso da planilha eletrônica e para isso é necessário que existam mecanismos capazes de proporcionar o uso consciente e preciso dessas planilhas, aplicando os conceitos de Gerenciamento de Risco, Integridade e Segurança de Dados.
E para conseguir isso, temos algumas diretrizes e informações relacionadas dentro do Guia 33/2020. Tendo o foco voltado inicialmente para o uso da planilha devemos classificá-la por “Tipo de Planilha”, conforme descrito abaixo e cuja abordagem está devidamente definida no guia:
- Planilhas descartáveis;
- Planilhas retidas como documentos;
- Planilhas usadas como banco de dados;
- Planilhas do tipo template;
- Banco de dados de área de trabalho.
Ressaltamos ainda que independentemente do tipo de planilha em uso e/ou em desenvolvimento, essa planilha precisa possuir uma identificação única e rastreável, também deve possuir as suas características, funcionalidades e aplicabilidades devidamente documentadas dentro do sistema da qualidade de forma a comprovar no mínimo que os cálculos, as informações e especificações presentes nos documentos gerados, estão coerentes e similares com a planilha que será utilizada, seguindo assim as diretrizes relacionadas às Boas Práticas de Documentação.
Além da classificação tipo dessas planilhas, é aconselhado que as planilhas sejam categorizadas, sendo que frente ao Guia 33/2020 é proposto o uso da sistemática apresentada pelo GAMP5 que divide as planilhas nas seguintes categorias:
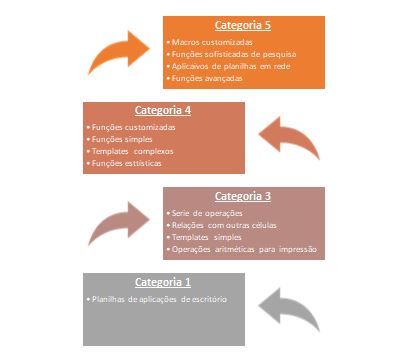
Em resumo, é necessário ter bem definido e especificado que tipo de abordagem será aplicada a cada grupo de planilha, devendo essa abordagem estar baseada e vinculada ao “Tipo de Planilha”, ao “Potencial Risco Associado” e por fim na “Categoria” dessa planilha ou grupo de planilhas eletrônicas.
Vale destacar uma informação que é apresentado no Guia 33/2020 da ANVISA, especificamente no item 14 Validação de Planilhas:

Essa afirmação, vem para apresentar uma grande verdade dentro das nossas rotinas, uma vez que muitas vezes não damos a total importância, bem como não temos estratégias devidamente definidas para a real e correta abordagem das atividades a serem desenvolvidas e aplicadas para um adequado Ciclo de Vida das Planilhas Eletrônicas o que acaba por configurar um grande gap dentro das nossas atividades e consequentemente do nosso sistema da qualidade.
Olhando por esse lado e buscando a aplicação e atendimento do Capítulo III – Disposições Específicas presente na Instrução Normativa 43/2019 que dispõem das diretrizes complementares de boas práticas de fabricação de sistemas computadorizados, são apresentados alguns itens e/ou requisitos que precisam estar devidamente estruturados dentro da nossa atividade de validação de planilhas eletrônicas, a saber:

Avaliando esses itens, e visando alcançar e implementar uma rotina em conformidade com as recomendações e requerimentos, retornamos à necessidade de conhecer de forma adequada e profunda o processo, visando assim o foco e aplicação desse dentro das rotinas e funcionalidades relacionadas ao uso planilha, tendo sempre em mente uma cultura relacionada a Integridade de Dados e para isso, devemos aplicar os conceitos de ALCOA e/ou ALCOA+, que prevê:
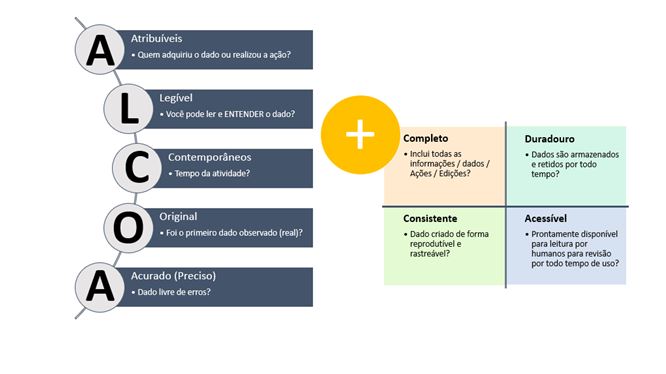
Sendo assim, identificamos que as possibilidades e abordagens relacionadas tanto ao processo de desenvolvimento do Ciclo de Vida das Planilhas Eletrônicas, quanto do Ciclo de Validação das Planilhas Eletrônicas devem ser encarados e categorizados assim como os processos de Validação de Sistemas Computadorizados adotados para sistemas embarcados e/ou informatizados, buscando especificamente sempre a implementação de melhorias e desenvolvimentos contínuos, atrelados as novas tendências regulatórias e que garantam a obtenção de um ciclo contínuo, seguro, íntegro e rastreável para os fluxos e dados relacionados e gerenciados por essa classe de sistema que, de tão acessíveis e flexíveis tornam-se difíceis, mas não impossíveis, de atenderem ao máximo as normas regulatórias e de serem corretamente gerenciados, validados e controlados.
Referências:
- ANVISA; Guia N° 33 / 2020 – Guia de Validação de Sistemas Computadorizados – Abril / 2020;
- ANVISA; Instrução Normativa – IN nº 43, de 21 de agosto de 2019;
- ANVISA; Resolução – RDC nº 301, de 21 de agosto de 2019;
- GAMP 5 – A Risck-basea Approach to Compliant GxP Computerized Systems – ISPE
- ICH Harmonised Guideline – Quality Risk Management Q9 – 9 November 2005
- PIC/S Guidance on Good Practices for Computerized Systems in Regulated “GxP” Environments (PI 011- 3)
Escrito por:
Paulo Henrique Pinto
Farmacêutico Generalista formado pela Universidade do Vale do Sapucaí – UNIVÁS. Atua na área industrial farmacêutica desde 2001, passando pelas áreas de Tecnologia da Informação e Garantia da Qualidade. Trabalha hoje focado nas atividades de Validação de Sistemas Computadorizados dentro das indústrias Life Science sendo esse participante do grupo de Mentoria Premium da Daniela Silva.
Saulo Dias Abreu:
Farmacêutico Generalista formado pela Universidade Presidente Antônio Carlos – UNIPAC, campus Juiz de Fora – MG. Atua na área industrial farmacêutica desde 2011, atuando dentro da Garantia da Qualidade com foco principal voltado para as atividades de Qualificação e Validação. Trabalha hoje focado nas atividades de Validação de Sistemas Computadorizados dentro das indústrias Life Science sendo esse participante ativo dos grupos de Mentoria Premium, Platinun e do Instituto de Qualidade, Qualificação e Validação (IQQV) de Daniela Silva.
