
Indicadores da Qualidade e Revisão da Gestão.
Categoria: Artigo, Blog, qualificação
O guia ICH Q10 – Sistema de Qualidade Farmacêutica (SQF) tem como objetivo dar diretrizes para um sistema de qualidade capaz de atingir a liberação de produtos com segurança, eficácia e qualidade, assim como a manutenção eficaz do SQF, a partir do estreitamento da relação do desenvolvimento farmacêutico e das atividades de fabricação dos medicamentos, proporcionando os processos de inovação e melhoria contínua, conforme demonstrado na figura 1.
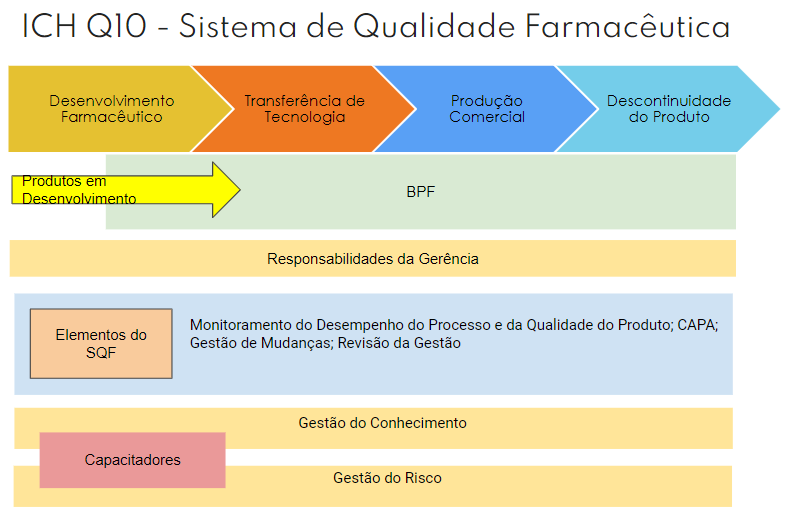
Figura 1 – Diagrama SQF – Fonte: ICH Q10.
Os estágios do ciclo de vida de produtos incluem as etapas de desenvolvimento farmacêutico, transferência de tecnologia, fabricação comercial e descontinuação do produto, conforme demonstrado na figura 2. Portanto, é esperado que o gerenciamento de risco da qualidade esteja presente em todas as etapas do ciclo de vida de produtos e que seja adequado em relação ao conhecimento disponível do processo e dos produtos, assim como em relação aos potenciais danos devendo esse ser realizado com uma abordagem proativa; conforme prevê o guia ICH Q9 – Gerenciamento de Riscos da Qualidade; para que as decisões sejam tomadas com base em ciência e no risco relacionado ao produto, levando em considerando os potenciais riscos ao paciente.
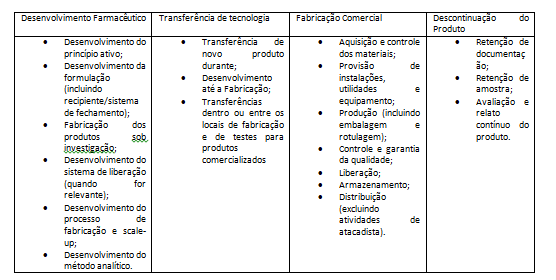
Figura 2 – Ciclo de vida de produtos – Fonte: ICH Q10.
Para a efetividade do gerenciamento de risco da empresa é necessário que a empresa tenha a gestão do conhecimento dos processos e produtos desde a fase de desenvolvimento até a descontinuação de produtos. A gestão do conhecimento se caracteriza pela sistematização do processo de aquisição, análise, armazenamento e disseminação das informações relacionadas aos processos e produtos; tais informações podem ser provenientes do documento de desenvolvimento farmacêutico, atividades de transferência de tecnologia, estudos de validação e de qualificação, entre outas.
O Sistema de Qualidade Farmacêutica deve incluir elementos como o monitoramento de processos e da qualidade do produto, ações corretivas e preventivas, gestão de mudanças e a revisão da gestão. A revisão da gestão, em específico, trata-se de um processo oportuno e eficaz de comunicação e encaminhamentos das questões de qualidade aos níveis apropriado de gestão, o que promovem melhorias nos processos e nos produtos, alinhamentos / realocações de recursos e provisão de treinamentos de pessoal, assim como a disseminação de conhecimento aos envolvidos.
A RDC 658/2022 – Boas Práticas de Fabricação de Medicamentos (ANVISA) estabelece no seu artigo 4 § 3 que “o Sistema da Qualidade Farmacêutica deve ser totalmente documentado e ter sua efetividade monitorada, por meio de revisão gerencial, de forma a promover a melhoria contínua da qualidade” e complementa no seu artigo 10 que “deve haver revisão gerencial periódica, com o envolvimento da administração superior da empresa, do desempenho do Sistema de Gestão da Qualidade Farmacêutica de forma que se identifiquem oportunidades de melhoria contínua de produtos, processos e do próprio sistema”. Portanto, a revisão gerencial, proposta no guia ICH Q10, trata-se de um requisito preconizado na regulamentação de BPF de medicamentos no Brasil.
Os indicadores de desempenho alinhados aos objetivos da qualidade são utilizados para monitorar a efetividade dos processos do SQF e o atingimento das metas pré-estabelecidas, sendo esses fundamentais para o entendimento da saúde da qualidade da empresa. Portanto, é importante que essa avaliação inclua:
- Avaliação da capacidade do sistema de qualidade em produzir e liberar produtos que atendam aos critérios de qualidade, segurança e eficácia. Podendo ser entendido pelos indicadores dos processos relacionados à reclamações de mercado e liberação de produtos, recolhimentos, por exemplo.
- Capacidade do sistema de qualidade em manter o estado de controle para os processos relacionados à cadeia produtiva. Podendo ser entendido pelos indicadores dos processos relacionados à desvios, CAPAs, RQP, por exemplo.
- Avaliação do nível de atendimento do site em relação aos requisitos de BPF preconizados nas resoluções e instruções normativas da agência de saúde brasileira – ANVISA. Podendo ser entendido pelos indicadores dos processos relacionados à GAP analysis (análises de lacunas), auditorias internas, inspeções sanitárias, auditorias de clientes, por exemplo.
Um indicador-chave de qualidade é muito mais do que estabelecer somente uma métrica, muitas vezes relacionada à volumetria de tarefas ou entregáveis das equipe de qualidade, tais como a quantidade de lotes liberados, reclamações recebidas, desvios registrados, entre outros índices dos processos de SQF.
Para que o monitoramento da qualidade seja efetivo é importante que os indicadores (KPIs) estejam alinhados ao planejamento estratégico da empresa e aos objetivos da qualidade. Os KPIs (Keys performance indicators, ou indicadores-chave de desempenho, em português) é uma ferramenta para medir o sucesso do SQF nos objetivos da qualidade e a efetividade das atividades na estratégia empresarial.
Para a definição de um indicador de qualidade é importante que ele atenda à 5 requisitos conhecido pelo acrônimo SMART (Specific, Measurable, Attainable, Relevant, Time-based), que em português significa que um indicador precisa ser específico, mensurável, atingível, relevante e ter um tempo definido. Portanto, é importante:
- Entender quais indicadores vão trazer maior valor para o entendimento da qualidade de produtos e processos. Sabemos que todos os processos do SQF são importantes e fundamentais para a qualidade dos produtos e processos, porém há processos mais sensíveis, ou seja, que representem de forma mais direta o seu impacto na qualidade. Por exemplo, o processo de reclamação de mercado demonstra de forma direta a insatisfação de clientes com o produto, portanto, tal aspecto possui relevância para a qualidade de modo que essa possa atuar proativamente à esse indicador.
- Além de ser relevante, é preciso que o indicador seja específico, não há ganhos quando os indicadores são tão genéricos. Por exemplo, medir somente o número de reclamações recebidas talvez não traga os benefícios necessários para a relevância do indicador de desempenho da empresa. Portanto, é necessário especificar o que se quer estudar a partir do indicador e como deve ser a métrica desse indicador, por exemplo, medir as reclamações de mercado dos produtos em relação às suas unidades fabricadas e liberadas ao mercado consumidor.
- “Não se gerencia o que não se mede” (William Edwards Deming), portanto, é imprescindível que o indicador seja mensurável e que a métrica esteja estabelecida para o correto cálculo. Por exemplo, para a avaliação das reclamações de mercado dos produtos em relação às suas unidades fabricadas e liberadas ao mercado consumidor, temos que:

Todo indicador precisa de uma meta, a qual deve ser atingível, portanto, é preciso que, apesar de desafiadora, a meta estabelecida, seja realista e possível de ser atingida. Por exemplo, pode-se estabelecer como meta que o % de reclamações recebidas em relação às unidades produzidas não ultrapassem 0,05%. Ou seja, em uma fabricação de 20.000 unidades, não poderia haver mais do que 10 reclamações de mercado.
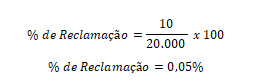
É importante estipular o tempo de coleta e avaliação dos KPIs, além do ciclo de avaliação para o cumprimento dos objetivos da qualidade pré-definidos. Por exemplo, os indicador de reclamação de mercado será avaliado mensalmente dentro do ciclo de meta para o ano (12 meses de avaliação).
Após as definições dos indicadores, esses podem ser avaliados a partir da organização dos dados em formato de tabela ou graficamente, conforme exemplificado a seguir:
Os dados apresentados a seguir são fictícios, sendo utilizados somente para fins didáticos de exemplificação.

No processo de revisão da gestão podem ser propostos CAPAs para correção dos resultados negativos observados nos indicadores, assim como sugestões de melhorias que forem avaliadas ao longo do período de revisão, sendo possível o uso de ferramentas da qualidade complementares. Por exemplo, utilizando-se do exemplo anterior, foi observado que para o produto 5 é possível melhorias no processo (torque de fechamento), conforme o gráfico de Pareto a seguir, no qual foram elencados os defeitos reclamados, sendo observada a maior incidência na reclamação relacionada à dificuldade ao abrir, sendo os demais defeitos subjacentes à esse defeito principal.

Em suma, o processo de revisão da gestão, além de um requisito de BPF no Brasil, é fundamental para a avaliação da saúde do sistema de qualidade da empresa; sendo possível observar o sucesso no atingimento das metas da qualidade e a efetividade da estratégia da empresa. Os indicadores permitem correções ao longo do ciclo de avaliação para que os resultados estejam alinhados com as expectativas pré-estabelecidas no início de cada ciclo de avaliação. Além disso, a revisão da gestão, em específico, trata-se de um processo oportuno e eficaz de comunicação e encaminhamentos das questões de qualidade aos níveis apropriado de gestão, conforme proposto no guia ICH Q10.
Para a definição dos KPIs, é importante entender quais indicadores vão trazer maior valor para o entendimento da qualidade de produtos e processos e que ele seja específico pois não há ganhos quando os indicadores são tão genéricos. Além disso, os indicadores precisam ter metas mensuráveis e atingíveis dentro de um espaço de tempo pré-definido.
Ao longo das revisões da gestão é possível estabelecer melhorias a partir da avaliação dos dados apresentado, podendo ser propostos CAPAs para essas, bem como complementar as avaliações a partir de outras ferramentas da qualidade que auxiliem na avaliação/tomada de decisão.
Referências
RDC 658/2022 – Boas Práticas de Fabricação de Medicamentos (ANVISA)
ICH Q10 – Sistema de Gestão Farmacêutica
ICH Q9 – Gerenciamento de Riscos da Qualidade
Sobre o autor:
Rodolfo Andrade Rodrigues é Bacharel em Química com Atribuições Tecnológicas, Especialista em Estatística Aplicada, MBA em Desenvolvimento de Pessoas e graduando em Estatística. Atua na indústria farmacêutica desde 2008 como especialista em sistemas de qualidade. (https://www.linkedin.com/in/rodolfo-andrade-rodrigues/)
