
ENTENDENDO O PROCESSO DO GERENCIAMENTO DE RISCO
Categoria: Artigo, Blog, qualificação
Através do site (https://www.ich.org/), observa-se o início do ICH com a criação em 1990 do Conselho Interacional para Harmonização de Requisitos Técnicos para Produtos Farmacêuticos para Uso Humano , conhecido através da ICH, reuniram autoridades reguladoras e indústrias farmacêuticas para discutirem aspectos científicos e técnicos referentes ao registro medicamento. A evolução do ICH surge gradualmente frente a cada desenvolvimento de novos produtos para mercado. O ICH tem como missão alcançar harmonização em indústrias no mundo, oferecendo confiabilidade de medicamentos/produtos seguros, eficazes, com alta performance na qualidade sejam para novos produtos em desenvolvimento ou os registrados, gerando maior confiabilidade em todo processo.
Algumas mudanças ocorreram e veem ocorrendo, o crescimento, deixando de ser conselho e tornando em organização, com aumento de números participantes. Brasil passa a compor o comitê gestão ICH através da assembleia em outubro de 2015 pelos membros do ICH.
Com a harmonização, marcos fundamentais surgem, assegurando a qualidade como referência na realização de estudos de estabilidade, definição de limites e testes de impurezas, flexibilização através do ICH a qualidade farmacêutica, referenciando gerenciamento de riscos como pilar para Boas Práticas de Fabricação (BPF).
Através das diretrizes ICH Q9 sobre gerenciamento de riscos da qualidade torna-se um valioso componente de um sistema da qualidade eficaz e eficiente.
Nos últimos meses, o setor farmacêutico gira em torno do “ Gerenciamento de Risco’, após a implementação a RDC 301/2019 e suas respectivas INs (instruções normativas).
A definição da frase “Gerenciamento de Risco”, separando as palavras, extraímos do dicionário a definição clara para cada palavra, para facilitar entendimento:
- Gerenciamento: substantivo masculino/ por definição: ação ou efeito de gerenciar; gerência.
- Risco: substantivo masculino/ por definição: probabilidade de perigo, ger. com ameaça física para o homem e/ou para o meio ambiente.
A definição Jurídica a palavra Risco, é definida como: Responsabilidade ou encargo acerca da perda ou do dano por situação de risco.
A união das palavras “Gerenciamento + Risco”, entendemos que Gerenciamento de Riscos é o processo de planejar, organizar, dirigir e controlar os recursos humanos e materiais de uma organização, no sentido de minimizar os efeitos dos riscos sobre essa organização ao mínimo possível. É um processo sistemático que permite acessar, controlar, comunicar e revisar os riscos para a qualidade de medicamentos durante seu prazo de validade. Incluindo em seu processo redução da probabilidade de ocorrer eventos negativos e aumentando a probabilidade de eventos positivos.
Assim, fica claro que, os processos nas indústrias farmacêuticas, antes de tudo o planejamento está associado diretamente ao gerenciamento do risco.
Conforme o Guia de harmonização técnicas reguladores, o objetivo o ICH Q9, descreve que:
(…) O objetivo deste documento é oferecer uma abordagem sistemática ao gerenciamento de riscos de qualidade. Ele serve como documento de base ou recurso independente de, ainda que apoie, outros ICH Quality documenta e complementa as práticas, requisitos, padrões e diretrizes de qualidade existentes indústria farmacêutica e ambiente regulatório. Fornece especificamente orientações sobre os princípios e algumas das ferramentas de gerenciamento de risco da qualidade que podem possibilitar decisões consistentes e baseadas em risco, tanto pelos reguladores quanto pela indústria, sobre a qualidade dos medicamentos substâncias e medicamentos (medicamentos) em todo o ciclo de vida do produto. Não se destina a criar nenhumas novas expectativas além dos requisitos regulatórios atuais (…) (manual ICH Q9 – 2015).
O manual ou guia conforme cada profissional refere-se, não cria novas expectativas além dos requisitos regulatórios atuais.
Nem sempre o que é apropriado, nem sempre é necessário usar durante o processo formal de gerenciamento de riscos, sendo as ferramentas conhecidas o e / ou procedimentos internos, por exemplo, procedimentos operacionais padrão). O uso de informações coletados durante e pós os processos também podem ser considerados aceitáveis. O uso adequado do gerenciamento de riscos da qualidade pode facilitar, mas não impede a indústria, a obrigação de cumprir os requisitos regulamentares e não substitui as comunicações apropriadas entre indústria e agências reguladoras de cada país, conforme suas leis.
No âmbito da qualidade o guia fornece os princípios e exemplos de ferramentas para a execução no gerenciamento que podem ser aplicados a diferentes aspectos da qualidade farmacêutica.
Incluindo o desenvolvimento, processos de fabricação, distribuição e inspeção e envio / revisão em todo o ciclo de vida de substâncias, medicamentos (medicamentos), produtos biológicos e biotecnológicos (incluindo o uso de matérias-primas, solventes, excipientes, materiais de embalagem e rotulagem em medicamentos (medicamentos), produtos biológicos e biotecnológicos), conforme atual norma regulatória RDC 301/2019 e IN´s.
A avaliação do risco tem por base o conhecimento científico associado a proteção do paciente e o nível sistemático de avaliação no processo, através de controle, comunicação e revisão riscos durante ciclo de vida do produto.
Abaixo diagrama extraído do Guia (ICH Q9 – figura 1), exemplo para o gerenciamento de risco da qualidade.
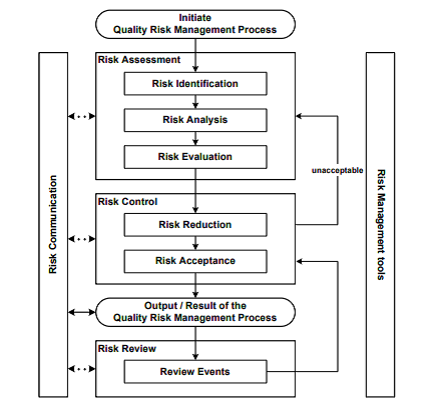
Existem outros modelos e/ou exemplos a serem utilizados, a avaliação para cada caso, devem ser estudados e avaliados em separados, por suas particularidades e especificidades.
As definições e atribuições, qual ferramenta usar, atribui a responsabilidade de uma equipe interdisciplinar, onde muitas vezes isso não e possível por inúmeros fatores. A equipe interdisciplinar geralmente formada por especialistas das áreas apropriadas e colaboradores com conhecimento sobre o risco.
As decisões frente ao processo gerenciamento de riscos, deve ser definido de forma clara e objetiva, implantada e revisada quantas vezes forem necessárias. Deve ser incluído processos sistêmicos projetados para coordenar, facilitar e melhorar a tomada de decisão com perfil ao risco (conforme a definição do ICH).
Etapas usadas para iniciar e planejar o Gerenciamento de risco incluem:
- Definir causa raiz ou a questão risco, com a identificação potencial risco a ser gerado;
- Reunir informações básicas ou dados sobre os possíveis perigos, danos ou impacto relevante a avaliação risco;
- Identificar os colaboradores essenciais ao processo;
- Gerar cronograma, com entregas e nível apropriado de tomada de decisão.
A avaliação do risco, está ligado ao reconhecimento de perigos e no estudo associados a exposição as essas ameaças. Cada verificação do risco de qualidade inicia pela descrição da causa raiz, com informações necessárias e objetivas sendo facilmente identificável. Três questionamentos fundamentais que irão auxiliar para definição dos riscos (conforme guia ICH Q9)
1. O que pode dar errado?
2. Qual é a probabilidade (probabilidade) de dar errado?
3. Quais são as consequências (gravidade)?
Primeiro passo identificar o risco, informações podem incluir dados históricos, análise, opiniões informadas e preocupações da empresa ou equipe técnica. A identificação do risco está relacionado a pergunta “ o que pode dar errado? ” está relacionada as possíveis consequências da falha/desvio/risco como queira determinar, com está identificação torna-se a base para o processo.
Identificado o risco, a análise do risco estará associada ao perigo, como qualitativo ou quantitativo com a probabilidade de ocorrência e gravidade dos danos, para auxílio escolha uma das ferramentas do gerenciamento com a capacidade de detectar os danos e também fatores na estimativa de risco. As ferramentas a serem utilizadas deverão ser adotadas conforme a necessidade. Riscos específicos nem sempre requerem a mesma ferramenta. A identificação/análise, são fontes de incertezas de falha e na falta conhecimentos dos processos, bem como a probabilidade na detecção dos erros.
O resultado de uma avaliação de risco é uma estimativa quantitativa do risco ou uma descrição qualitativa de um faixa de risco. Quando o risco é expresso quantitativamente, é utilizada uma probabilidade numérica. Alternativamente, risco pode ser expresso através informações qualitativas, como “alto”, “médio” ou “baixo”, que devem ser definidos com o máximo de detalhes possíveis. Às vezes, uma “pontuação de risco” é usada para definir melhor itens em classificação de risco. As avaliações quantitativas de risco, uma estimativa de risco fornece a probabilidade de uma consequência, do conjunto de circunstâncias geradoras de risco. Assim, a estimativa quantitativa do risco é útil por uma consequência particular de cada vez. Como alternativa, algumas ferramentas de gerenciamento de risco usam um risco relativo para avaliar vários níveis de gravidade e probabilidade em uma estimativa geral do risco relativo.As etapas intermediárias em um processo de pontuação às vezes podem empregar estimativa quantitativa de risco.
Controlar o risco inclui a tomada de decisões para reduzir a nível aceitável. E a quantidade necessária de esforço usada para diminuir ameaças do processo num todo, para determinar nível ideal e aceitável, o que poderá gerar um custo-benefício para obter o controle. Para chegar próximo ao ideal de segurança, três perguntas devem ser respondidas durante a etapa, sendo elas:
•O risco está acima de um nível aceitável?
•O que pode ser feito para reduzir riscos?
- Qual é o equilíbrio apropriado entre benefícios, riscos e recursos?
- Os riscos identificados conseguiram serem controlados?
A redução de riscos concentra-se nos processos limitantes ou prevenção do risco de qualidade quando excede um Nível especificado (aceitável). A redução de risco pode incluir ações tomadas para mitigar a gravidade e probabilidade de dano. Processos que melhoram a detecção de perigos e riscos de qualidade também podem ser usados como parte de uma estratégia de controle de risco. A implementação de medidas de redução de risco poderá gerar novos riscos ou aumentar o impacto de outros riscos até então despercebidos. Nesse caso, uma nova avaliação deverá realizada, para identificar e verificar os impactos no processo referente a redução dos riscos.
O risco residual (não há como eliminar), a falha existe, ação preventiva e corretiva deve ser implantada para não impactar, vai depender como será parâmetro do nível de aceitação, avaliando cada caso, em nenhum momento deverá ser avaliado os riscos residuais como um único caso.
A Comunicação de risco é o compartilhamento de informações sobre riscos e gerenciamento de riscos entre os tomadores de decisão e outros. As partes podem se comunicar em qualquer estágio do processo de gerenciamento de riscos.
O resultado do processo de gerenciamento de risco da qualidade deve ser adequadamente comunicado e documentado. Comunicações podem incluir aqueles entre as partes interessadas; por exemplo, agências reguladoras e indústria, indústria e paciente, dentro da própria empresa, etc. As informações incluídas podem estar relacionadas a:
Existência, natureza, forma, probabilidade, gravidade, aceitabilidade, controle, tratamento, detecção ou outros aspectos dos riscos à qualidade. A comunicação não é necessária a cada aceitação de risco aos órgãos reguladores.
Atenção, entre a indústria e as autoridades reguladoras, a comunicação relativa ao gerenciamento de riscos de qualidade, as decisões podem ser efetuadas pelos canais existentes, conforme especificado em regulamentos e diretrizes.
A Revisão de riscos é uma parte contínua do processo de gerenciamento da qualidade. Um mecanismo para revisar ou monitorar eventos que devem ser implementados em todas as empresas. Os resultados do processo de gerenciamento de riscos devem ser revisados avaliando novos conhecimentos e experiências. Uma vez iniciado esse processo deve continuar a ser utilizado evitando impactar o gerenciamento original dos riscos de qualidade nas decisões, se esses eventos são planejados, por exemplo, ( resultados de revisão de produtos, inspeções, auditorias, controle de alterações) ou não planejado , por exemplo,( causa raiz de investigações de falha, recall). A frequência de qualquer revisão deve ser baseada no nível de risco. A revisão de risco pode incluir uma nova avaliação de risco com decisões de aceitação.
Metodologia de gerenciamento de riscos é composto de documentados transparentes e reprodutíveis baseado conhecimento atual sobre a avaliação da probabilidade, gravidade e detecção do risco, podendo ser usado abordagem científica e pratica para tomada de decisões.
Tradicionalmente, os riscos à qualidade são avaliados e gerenciados de várias maneiras informais (empíricas). Essas abordagens continuam a fornecer informações úteis que podem apoiar tópicos como tratamento de reclamações, defeitos de qualidade, desvios e alocação de recursos. Além disso, a indústria farmacêutica e os órgãos reguladores podem avaliar e gerenciar riscos usando métodos reconhecidos através das ferramentas de gerenciamento de riscos e / ou procedimentos internos (por exemplo, procedimentos operacionais padrão).
Algumas dessas ferramentas mencionadas no texto abaixo:
•Métodos básicos de facilitação do gerenciamento de riscos (fluxogramas, folhas de verificação etc.);
•Análise de efeitos de modo de falha (FMEA);
•Modo de falha, efeitos e análise de criticidade (FMECA);
•Análise de Árvore de Falhas (TLC);
•Análise de Perigos e Pontos Críticos de Controle (HACCP);
•Análise de Operabilidade de Perigos (HAZOP);
•Análise Preliminar de Perigos (PHA);
•Classificação e filtragem de riscos;
•Suporte a ferramentas estatísticas.
Pode ser apropriado adaptar essas ferramentas para uso em áreas específicas relacionadas a substâncias e medicamentos, a qualidade do medicamento (medicamento). Métodos de gestão de riscos de qualidade e as ferramentas estatísticas de apoio pode ser usado em combinação (por exemplo, avaliação probabilística de riscos). O uso combinado fornece flexibilidade que pode facilitar a aplicação dos princípios de gerenciamento de risco da qualidade. O grau de rigor e formalidade da gestão de riscos da qualidade deve refletir os conhecimentos e ser proporcional à complexidade e / ou criticidade do problema a ser tratado.
A Integração da gestão de riscos de qualidade na indústria e operações regulatórias, é um processo que auxilia nas decisões práticas e integradas nos sistemas de qualidade. Conforme descrito na introdução, o uso apropriado do gerenciamento de riscos de qualidade não isenta a obrigação do setor de cumprir com os regulamentos e requisitos. No entanto, uma gestão eficaz dos riscos de qualidade poderá facilitar a melhor e mais informada decisão, pode fornecer aos órgãos reguladores maior garantia da capacidade de uma empresa de lidar com possíveis riscos, afetar a extensão e o nível da supervisão regulatória direta. O treinamento do pessoal da indústria e da regulamentação em processos de gerenciamento de riscos de qualidade fornece maior entendimento dos processos de tomada de decisão e constrói confiança no gerenciamento de riscos da qualidade quando os resultados apresentam segurança e confiabilidade no processo de gerenciamento de riscos de qualidade deve ser integrado às operações existentes e deve ser documentado adequadamente.
Embora as decisões regulatórias continuem sendo tomadas em uma base regional, um entendimento e aplicação de princípios de gestão de riscos de qualidade poderia facilitar a confiança mútua e promover mais decisões consistentes entre os reguladores com base nas mesmas informações. Essa colaboração poderia ser importante no desenvolvimento de políticas e diretrizes que integram e apoiam o risco à qualidade e nas práticas de gerenciamento.
A nova resolução traz consigo essa política, da segurança e confiabilidade no processo da industrial farmacêutico, cabe a cada empresa fazer sua parte.
Referências
ICH Q8 Desenvolvimento Farmacêutico.
Guia ISO / IEC 73: 2002 – Gerenciamento de riscos – Vocabulário – Diretrizes para uso em padrões.
Guia ISO / IEC 51: 1999 – Aspectos de segurança – Diretriz para a inclusão nos padrões.
Mapeamento de Processos pelo Centro Americano de Produtividade e Qualidade, 2002, ISBN 1928593739.
IEC 61025 – Análise de Árvore de Falhas (TLC).
Técnicas de análise IEC 60812 para confiabilidade do sistema – procedimentos para análise de efeitos e modo de falha
(FMEA).
Análise de Modo e Efeito de Falha, FMEA de Teor to Execution , 2ª Edição 2003, DH Stamatis,
ISBN 0873895983.
Diretrizes para análise de modos e efeitos de falhas (FMEA) para dispositivos médicos , 2003 Dyadem Press,
ISBN 0849319102.
Noções básicas de FMEA , Robin McDermott, Raymond J. Mikulak, Michael R. Beauregard 1996, ISBN
0527763209.
Série de relatórios técnicos da OMS nº 908, 2003, anexo 7 Aplicação da análise de perigos e controle crítico
Metodologia Point (HACCP) para produtos farmacêuticos .
IEC 61882 – Análise de Operabilidade de Perigos (HAZOP).
ISO 14971: 2000 – Aplicação de gerenciamento de riscos a dispositivos médicos.
ISO 7870: 1993 – Cartas de Controle.
ISO 7871: 1997 – Gráficos de soma cumulativa.
ISO 7966: 1993 – Cartas de controle de aceitação.
ISO 8258: 1991 – Cartas de Controle Shewhart.
O que é controle de qualidade total ?; Caminho Japonês, Kaoru Ishikawa (Traduzido por David J. Liu), 1985,
ISBN 0139524339.
Elaborado por:
Mari José Resende -Membro Mentoria Platinum em Qualificação e Validação e IQQV (Instituto de Qualificação e Validação)
Graduada em ciências farmacêuticas com habilitação em indústria pela Unaerp Ribeirão Preto/SP
Pós graduada em Vigilância sanitária e assuntos regulatórios pela Unievangelica de Anápolis/GO
